乳酸含量检测指南(科研):检测方法选择、WST-8比色原理、样本处理、标准曲线与故障排查

乳酸(Lactate)是代谢研究中高频使用的指标之一,常用于评估无氧代谢增强、能量代谢变化、细胞代谢重编程等科研现象。 这篇指南的目标是:让你拿到样本就能把实验做对——从选方法、配标曲、上板读数,到计算与排查问题,一页讲清。
一分钟速查
- 推荐方案:WST-8 比色法(LDH体系),450 nm读数,适合96孔板高通量
- 检测范围:0.03–2 mM(建议通过稀释让样本读数落在线性范围内)
- 适用样本:血清/血浆、动物组织/细胞样本、植物组织、尿液及其他生物液体
- 典型流程:配标曲 → 配工作液(现配现用)→ 加样 →37℃避光孵育约30 min → 读板 → 计算
- 样本保存:不立即检测可-80℃保存(建议不超过1个月),尽量减少反复冻融
- 试剂保存:-20℃避光保存(以各组分标签/说明书为准)
产品入口:乳酸检测试剂盒
1)乳酸怎么测:常见方法怎么选(科研场景)
乳酸检测常见路线包括比色法、荧光法、传感器/电极法,以及色谱/质谱等。
怎么选更省事?你只需要回答3个问题:
- 样本是什么(血清/组织/细胞/培养液/植物/尿液)?
- 样本量多不多(要不要96孔板高通量)?
- 浓度大概在哪个范围(是否需要更高灵敏度)?
经验建议:
- 样本多、追求快、希望一次跑一板→ 优先选择比色法(450 nm)
- 样本含量很低、希望更高灵敏度 → 可考虑荧光法或更高灵敏方案
要做代谢组、多指标联合或绝对定量要求极高 → 可考虑LC/GC-MS
2)WST-8比色法乳酸检测原理:为什么能在450 nm读数?
WST-8微量比色法通常基于乳酸脱氢酶(LDH)体系:
- LDH催化:L-乳酸 → 丙酮酸,同时NAD⁺ → NADH
- 递氢反应:NADH在递氢体系作用下与WST-8 反应
- 显色读数:生成黄色可溶性产物,在450 nm 测吸光度
- 线性关系:吸光度(扣空白后的ΔA)与乳酸浓度在一定范围内呈线性相关
这一体系的优点是:步骤少、适配96孔板、读数直观,适合大批量样本的科研检测。
3)样本处理:决定“准不准、稳不稳”的关键
产品支持的样本类型广,但不同样本的“坑位”不同。建议把下面三条当成默认动作:
1. 每个样本至少做2个稀释度
很多“测不准/重复性差”,本质原因是:样本浓度超范围或基质干扰。
做2个稀释度(例如 1× 和 5× / 10×)可以快速判断:
- 是否超出标准曲线线性区
- 是否存在明显基质背景
- 是否需要去蛋白/超滤
2. 建议设置的孔
- 空白孔:Buffer + 工作液(用于扣体系背景)
- 标准孔:建立标准曲线
- 样本孔:建议至少重复孔(duplicate)
- 背景孔(可选但很有用):用于扣除样本自身带来的背景(尤其是组织/细胞提取物)
3. 这些情况建议优先考虑去蛋白/超滤
- 样本颜色深/底色明显(部分植物组织、组织匀浆等)
- 背景偏高(怀疑NADH/NADPH或样本基质干扰)
- 样本中含较多蛋白或酶,担心影响反应体系或导致乳酸变化
4)不同样本怎么做:可直接照抄的处理思路
下面是常见“稳妥路线”,你们可以按实验体系微调:
- 血清/血浆/尿液/一般体液:多数情况下可直接检测;建议做稀释梯度,确保在线性区
- 细胞/细菌样本:PBS清洗 → Buffer裂解/超声 → 低温离心取上清;背景高时加做背景孔/净化
- 动物组织样本:冰浴匀浆 → 低温离心取上清;必要时去蛋白/超滤
- 植物组织样本:更容易出现底色/多酚等干扰,建议更重视净化与背景扣除
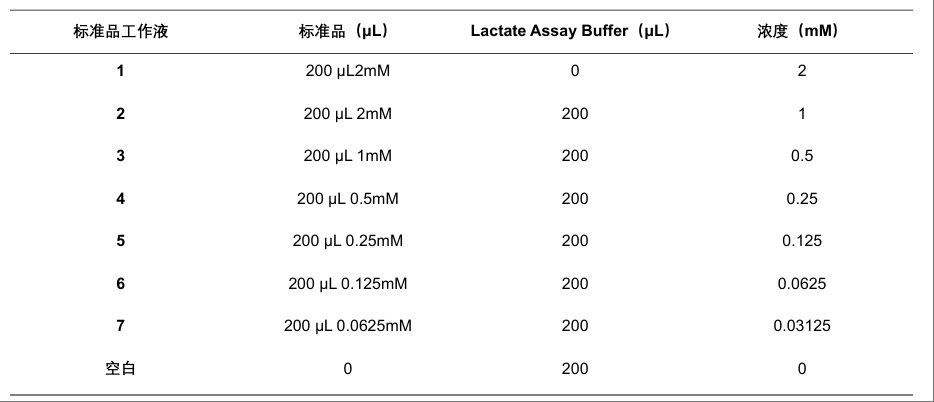
5)标准曲线怎么配:0.03–2 mM(关键长尾点)
标准曲线往往是“最容易翻车、也最影响准确度”的环节。建议每次实验同步做标曲(尤其是基质复杂样本)。
1. 标准品与梯度范围
该微量法的标准曲线范围覆盖0.03–2 mM。建议用1:2梯度稀释覆盖完整范围,并用Buffer作空白。
2. 一步一步配标曲
- 先由100 mM标准品配出2 mM标准储备液(常见做法:20 μL标准品 + 980 μL Buffer)
- 再做 1:2 梯度稀释:2 → 1 → 0.5 → 0.25 → 0.125 → 0.0625 → 0.03125 mM
Buffer 作为 0 mM 空白
6)96孔板实验流程:30分钟读板版本
这是一个典型的96孔板微量流程(以说明书体系为准):
- 仪器预热:酶标仪预热,设置波长450 nm
- 配工作液:按说明书配制工作液,建议现配现用
- 实操技巧:按“比实际孔数多10%”的量配,避免最后几孔临时补配导致批次差
- 上样反应体系:
- 标准孔:标准溶液 + 工作液
- 样本孔:样本 + 工作液
- 孵育:混匀后37℃避光孵育约30 min
- 读板:450 nm读取吸光度,记录空白/标准/样本数据
7)结果计算:ΔA、标准曲线、稀释倍数与归一化
1. 先扣空白得到ΔA
- ΔA标准 = A标准 − A空白
- ΔA样本 = A样本 − A空白
2. 用标准曲线求样本浓度
以“标准浓度”为y轴,“ΔA标准”为x轴拟合(常用线性拟合),将ΔA样本代入方程得到样本浓度 C。
3. 别忘了乘稀释倍数
如果样本稀释了 n 倍:最终浓度 = C × n
4. 组织/细胞样本建议做归一化
为了不同样本可比,建议提前选定统一口径输出:
- 按体积(mM)
- 按组织质量
- 按细胞数
- 按蛋白量(很多实验室更偏好这个口径)
8)故障排查:A值异常(过高/过低/背景大)怎么处理?
建议你们做成“现象-原因-动作”表格,用户收藏率高,也更容易覆盖问题型长尾词。
| 现象 | 常见原因 | 处理建议 |
|---|---|---|
| ΔA过高/接近饱和 | 样本浓度太高,超出线性区 | 增加稀释倍数,回到标曲范围内 |
| ΔA过低 | 浓度低/上样量不足/体系误差 | 增加样本量或降低稀释倍数;核对配液与孵育条件 |
| 背景偏大 | NADH/NADPH、样本底色、基质干扰 | 设置背景孔扣除;必要时去蛋白/超滤 |
| 重复性差 | 配液不一致/计时不一致/边缘孔效应 | 工作液一次配齐留余量;统一计时;必要时避免边缘孔 |
9)FAQ
Q1:需要做预实验吗?
建议做。用2–3个预期差异大的样本先跑一板,快速确定稀释倍数与线性区。
Q2:必须用酶标仪吗?
多数比色体系可兼容分光光度计,但需要按比色皿体系调整反应体积/比例(以说明书为准)。
Q3:标准曲线要每次都做吗?
建议每次都做,尤其是样本基质复杂时,标曲同步能显著提高可信度。
Q4:产品是否用于临床?
仅供科研使用,不用于人类或临床诊断。

