线粒体呼吸链复合体Ⅴ活性检测试剂盒实验解决方案

自备耗材·酶标仪或可见分光光度计(能测660 nm处的吸光度)·恒温箱、制冰机、低温离心机·96孔板或微量玻璃比色皿、可调节式移液枪及枪头·去离子水·匀浆器或研钵
试剂准备ReagentⅠ:即用型;使用前,平衡到室温;4℃保存。Reagent Ⅱ:即用型;使用前,平衡到室温;4℃保存。Reagent Ⅲ:即用型;使用前,平衡到室温;4℃避光保存。Reagent Ⅳ:临用前配制,48 T加入1 mL去离子水充分溶解,96 T加入2 mL去离子水充分溶解。未用完的试剂需分装后-20℃避光保存1个月,避免反复冻融。Reagent Ⅴ:即用型;使用前,平衡到室温;4℃保存。Reagent Ⅵ:临用前配制,48 T加入2.4 mL去离子水充分溶解,96 T加入4.8 mL去离子水充分溶解后使用。未用完的试剂需分装后-20℃避光保存1个月,避免反复冻融。Reagent Ⅶ:临用前配制,48 T加入7 mL去离子水充分溶解,96 T加入14 mL去离子水充分溶解后使用。未用完的试剂需分装后-20℃避光保存1个月,避免反复冻融。Reagent Ⅷ:临用前配制,48 T加入7 mL去离子水充分溶解,96 T加入14 mL去离子水充分溶解后使用。未用完的试剂需分装后-20℃避光保存1个月,避免反复冻融。Reagent Ⅸ:即用型;室温保存。定磷试剂的配制:配制比例按照去离子水 : Reagent Ⅶ : Reagent Ⅷ : Reagent Ⅸ=2:1:1:1的比例配制,配好的定磷试剂应为浅黄色。若无色则试剂失效,若是蓝色则为磷污染(请根据需要,现用现配)。注意:配试剂最好用新的玻璃器皿或者一次性塑料器皿,以避免磷污染。标准曲线设置:按下表所示用去离子水将10 mM标准品稀释为1、0.5、0.25、0.125、0.0625、0.0313、0.0156 mM的标准溶液。
序号 | 标准品体积(µL) | 去离子水体积(µL) | 标准品浓度(mM) |
Std.1 | 100 µL 10 mM | 900 | 1 |
Std.2 | 100 µL of Std.1 (1 mM) | 100 | 0.5 |
Std.3 | 100 µL of Std.2 (0.5 mM) | 100 | 0.25 |
Std.4 | 100 µL of Std.3 (0.25 mM) | 100 | 0.125 |
Std.5 | 100 µL of Std.4 (0.125 mM) | 100 | 0.0625 |
Std.6 | 100 µL of Std.5 (0.0625 mM) | 100 | 0.0313 |
Std.7 | 100 µL of Std.6 (0.0313 mM) | 100 | 0.0156 |
样本制备注意:推荐使用新鲜样本,以保证酶的活力。线粒体呼吸链复合体Ⅴ的提取:1.准确称取0.1 g组织或收集500万个细胞,加入1 mL ReagentⅠ和10 µL Reagent Ⅲ,用匀浆器或研钵冰浴匀浆;2.离心匀浆液,600 g,5 min,4℃,收集上清液至另一新的离心管中,舍弃沉淀;3.再次离心上清,11,000 g,10 min,4℃,沉淀即为提取的线粒体,用作第5步操作;4.(选做)上清液即为胞浆提取物,可作为样本用于测定从线粒体泄漏的线粒体呼吸链复合体Ⅴ(此步可选做,可用于判断线粒体提取效果);5.在沉淀中加入800 µL Reagent Ⅱ和8 µL Reagent Ⅲ,充分重悬沉淀,用于下一步线粒体呼吸链复合体Ⅴ酶活性检测。实验步骤1.酶标仪或可见分光光度计预热30 min以上,调节波长到660 nm,可见分光光度计用去离子水调零。2.酶促反应(在EP管中依次加入下列试剂):
试剂 | 空白管(μL) | 标准管(μL) | 测定管(μL) | 对照管(μL) |
Reagent IV | 0 | 0 | 10 | 10 |
Reagent V | 0 | 0 | 40 | 40 |
样本 | 0 | 0 | 50 | 0 |
混匀后盖紧,37℃(哺乳动物)或25℃(其它物种)准确孵育30 min | ||||
Reagent VI | 0 | 0 | 20 | 20 |
样本 | 0 | 0 | 0 | 50 |
1. 混匀后,室温(25℃左右),4,000 g,离心10 min,取上清液。 | ||||
2. 定磷(在96孔板或微量玻璃比色皿中加入下列试剂) | ||||
试剂 | 空白孔(μL) | 标准孔(μL) | 测定孔(μL) | 对照孔(μL) |
上清 | 0 | 0 | 40 | 40 |
Standards | 0 | 40 | 0 | 0 |
去离子水 | 40 | 0 | 0 | 0 |
定磷试剂 | 200 | 200 | 200 | 200 |
3. 混匀,室温静置10 min后,测定660 nm吸光值。计算ΔA测=A测定-A对照,ΔA标=A标准-A空白。(空白管只需做1管) | ||||
注意:1. 为保证实验结果的准确性,需先取1-2个样做预实验,如果测定的吸光值过高(高于1.5)可用Reagent Ⅱ稀释样本后再测定,计算结果时注意乘以稀释倍数。若ΔA测偏小,则可以通过增加加入的样本体积来提高检测数值,若ΔA测出现负值,则说明样本中不含复合体Ⅴ或已降解。2. Reagent Ⅲ具有一定的毒性,Reagent Ⅸ具有腐蚀性,请操作时做好防护措施。3. 该试剂盒提取的样本也可以适用于KTB1850、KTB1860、KTB1870、KTB1880的测定。
结果计算注意:我们为您提供的计算公式,包括推导过程计算公式和简洁计算公式。两者完全相等。建议以加粗的简洁计算公式为最终计算公式。1.标准曲线的绘制以标准液浓度为y轴,ΔA标为x轴,绘制标准曲线(浓度为y轴更方便计算结果)。2.无机磷(Pi)含量的计算将∆A测带入方程得到y值(mM)。3.线粒体呼吸链复合体Ⅴ活性计算(1) 按样本鲜重计算单位的定义:每g组织在反应体系中每分钟产生1 nmol无机磷定义为一个酶活性单位。上清中线粒体呼吸链复合体Ⅴ活性的计算:上清中复合体Ⅴ活性(U/g鲜重)=(y上清×V酶促×106)÷(V样÷V提取×W)÷T=80.8×y上清÷W沉淀中线粒体呼吸链复合体Ⅴ活性的计算:沉淀中复合体Ⅴ活性(U/g鲜重)=(y沉淀×V酶促×106)÷(V样÷V重悬×W)÷T=64.64×y沉淀÷W样本线粒体呼吸链复合体Ⅴ总活性的计算:样本线粒体呼吸链复合体Ⅴ总活性即为上清中线粒体呼吸链复合体Ⅴ活性与沉淀中线粒体呼吸链复合体Ⅴ活性之和。按样本质量计算:线粒体呼吸链复合体Ⅴ总活性(U/g鲜重) =80.8×y上清÷W+64.64×y沉淀÷W(2) 按细胞密度计算单位的定义:每1万个细胞每分钟产生1 nmol无机磷定义为一个酶活性单位线粒体呼吸链复合体Ⅴ活性(U/104 cells)=(y×V酶促×106)÷(V样÷V重悬×500)÷T=0.129×yV酶促:酶促反应体系总体积,1.2×10-4 L;106:单位换算系数,1 mmol=106 nmol;V样:加入样本体积,0.05 mL;T:反应时间,30 min;V提取:提取体系体积,1.01 mL;W:样本重量,g;V重悬:重悬沉淀体积,0.808 mL;500:细胞总数,500万。
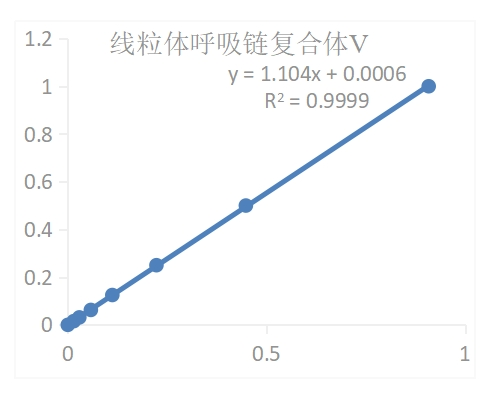
结果展示典型标准曲线:
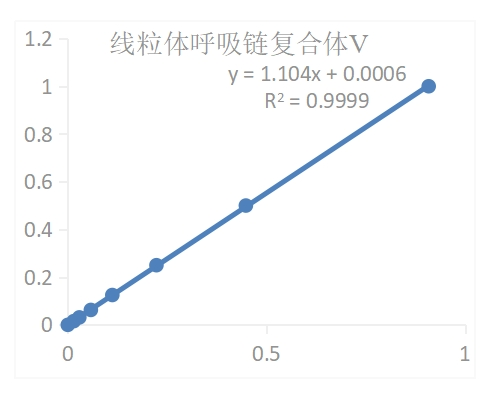 Figure 1. 96孔板分析的线粒体呼吸链复合体Ⅴ活性标准曲线。数据和曲线仅供参考,实验者需根据自己的实验建立标准曲线
Figure 1. 96孔板分析的线粒体呼吸链复合体Ⅴ活性标准曲线。数据和曲线仅供参考,实验者需根据自己的实验建立标准曲线实验实例:1.取0.1 g绿萝组织进行样本处理,按照测定步骤操作,用96孔板测得:ΔA上清=A测定-A对照=0.404-0.267=0.137,ΔA沉淀=A测定-A对照=0.355-0.142=0.213将∆A上清及ΔA沉淀带入方程,得到y上清=0.1518,y沉淀=0.23582.按样本质量计算得:上清中复合体Ⅴ活性(U/g鲜重)=80.8×y上清÷W=80.8×0.1518÷0.1=122.654 U/g沉淀中复合体Ⅴ活性(U/g鲜重)=64.64×y沉淀÷W=64.64×0.2358÷0.1=152.421 U/g则总复合体Ⅴ(U/g鲜重)=80.8×y上清÷W+64.64×y沉淀÷W=122.654+152.421=275.075 U/g
相关产品
Catalog No. | Product Name |
KTB1850 | CheKineTM 线粒体呼吸链复合体Ⅰ活性检测试剂盒(微量法) |
KTB1860 | CheKineTM 线粒体呼吸链复合体Ⅱ活性检测试剂盒(微量法) |
KTB1870 | CheKineTM 线粒体呼吸链复合体Ⅲ活性检测试剂盒(微量法) |
KTB1880 | CheKineTM 线粒体呼吸链复合体Ⅳ活性检测试剂盒(微量法) |


